Kurz vor Weihnachten hat die Bundesregierung ihre Pharma-Strategie beschlossen. Mit dem Aktionsplan soll Deutschland als Forschungs- und Produktionsstandort für die Pharmabranche attraktiver werden. Auch für die Arzneimittelpreisbildung sind Maßnahmen vorgesehen. Mit Blick auf die Dynamik des Arzneimittelmarkts rückt die Weiterentwicklung des AMNOG stärker in den Mittelpunkt der gesundheitspolitischen Diskussionen.
Berlin, 19.01.2024 – Im Gespräch bezieht Prof. Dr. Christoph Straub, Vorstandsvorsitzender der Barmer, Stellung zu den geplanten Maßnahmen und erläutert, wie aus seiner Sicht das AMNOG-Verfahren an die aktuellen Herausforderungen angepasst werden kann.
Herr Prof. Straub, mit der Pharma-Strategie sollen die Rahmenbedingungen für die Pharmaindustrie in Deutschland verbessert werden. Wie beurteilen Sie die Pläne der Bundesregierung?
Die Pharma-Strategie umfasst ja eine Vielzahl von Maßnahmen in ganz unterschiedlichen Bereichen, so sollen etwa klinische Studien vereinfacht und beschleunigt oder die Zuständigkeiten bei der Arzneimittelzulassung gebündelt werden. Ein zentraler Punkt ist aus meiner Sicht das Bekenntnis der Bundesregierung zur Förderung von Herstellungsstätten in der EU sowie zur Diversifizierung der Lieferketten.

Können Sie das erläutern?
Durch die Corona-Pandemie und bis heute auftretende Lieferschwierigkeiten versorgungsrelevanter Arzneimittel wie Krebsmittel und Antibiotika ist die Verfügbarkeit von Arzneimitteln stark ins öffentliche Bewusstsein gerückt. Oftmals lassen sich Lieferengpässe auf eine Konzentration der Wirkstoff- und Arzneimittelproduktion an einzelnen Standorten außerhalb Europas vor allem in Indien und China zurückführen.
Um die Versorgungssicherheit für unsere Versicherten zu erhöhen, müssen sowohl auf nationaler als auch auf europäischer Ebene Maßnahmen zur Stärkung der Arzneimittelproduktion getroffen werden, insbesondere für versorgungskritische Arzneimittel. Wichtig sind eine Diversifizierung der Lieferketten sowie ein einheitlicher Rahmen für die Einfuhr und Zulassung von Arzneimitteln aus Drittstaaten. Es ist gut, dass die Bundesregierung hierzu Instrumente prüft wie beispielsweise Investitionszuschüsse für Produktionsstätten in Deutschland. Allerdings sind die Vorschläge noch recht unkonkret.
Was sehen Sie kritisch?
Kritisch sind aus meiner Sicht die Vorschläge im Bereich der Arzneimittelpreisbildung. So soll der bislang öffentlich gelistete Erstattungsbetrag neuer Arzneimittel künftig vertraulich bleiben können. Das halte ich für einen großen Fehler, denn die Veröffentlichung des Erstattungsbetrages führt zu dringend benötigter Transparenz im Marktgeschehen. Die Vertraulichkeit wird mittelfristig weitere Kostenbelastungen für die Versichertengemeinschaft mit sich bringen. Dies ist deshalb kritisch, weil wir in den kommenden Jahren weiter mit deutlich steigenden Ausgaben aufgrund neuer hochpreisiger patentgeschützter Arzneimittel rechnen.
Vertrauliche Erstattungsbeträge sind ein großer Fehler. Wir brauchen Transparenz im Marktgeschehen.
Wie soll denn bei all den Kostendämpfungsmaßnahmen der Zugang zu Arzneimittelinnovationen aufrechterhalten werden? Oder anders gefragt: Wie kann aus Ihrer Sicht gewährleistet werden, dass neue Medikamente schnell auf den Markt kommen und gleichzeitig für die GKV bezahlbar bleiben? Ist das AMNOG hier noch das richtige Instrument?
Das 2011 eingeführte AMNOG als Preisverhandlungsverfahren für neue Arzneimittel hat sich bewährt. Das zentrale Element ist dabei nicht der Preis des Arzneimittels, sondern der Zusatznutzen gegenüber bestehenden Therapien.
Die Herausforderung für das AMNOG-Verfahren stellen seit einigen Jahren Arzneimittel gegen seltene Erkrankungen, so genannte Orphan Drugs, und andere Arzneien mit bedingter Zulassung dar. Diese Arzneimittel unterliegen seitens der Zulassungsbehörden deutlich geringeren Nachweispflichten zur Wirksamkeit und Verträglichkeit. Daher wird die Zulassung zumeist unter der Bedingung erteilt, weitere Daten zu erheben. Da das Arzneimittel aber zugelassen ist, müssen die Kassen es bezahlen, auch wenn der Nachweis über den Nutzen erst im Rahmen der Regelversorgung erforscht wird.
Pharmahersteller bringen auf Grund der geringeren Auflagen immer mehr Arzneimittel mit bedingter Zulassung auf den Markt, die sich in einem hochpreisigen Segment bewegen. Somit kann der Nutzen eines Arzneimittels im unmittelbar nach der Markteinführung startenden AMNOG-Verfahren in diesen Fällen gar nicht oder nur unzureichend ermittelt werden. Dies ist vor allem aus Sicht der Patientensicherheit kritisch. Nach Auffassung der Barmer muss der Nutzen neuer Arzneimittel in jedem Fall belegt sein – auch bei Orphan Drugs.
Was schlagen Sie konkret vor?
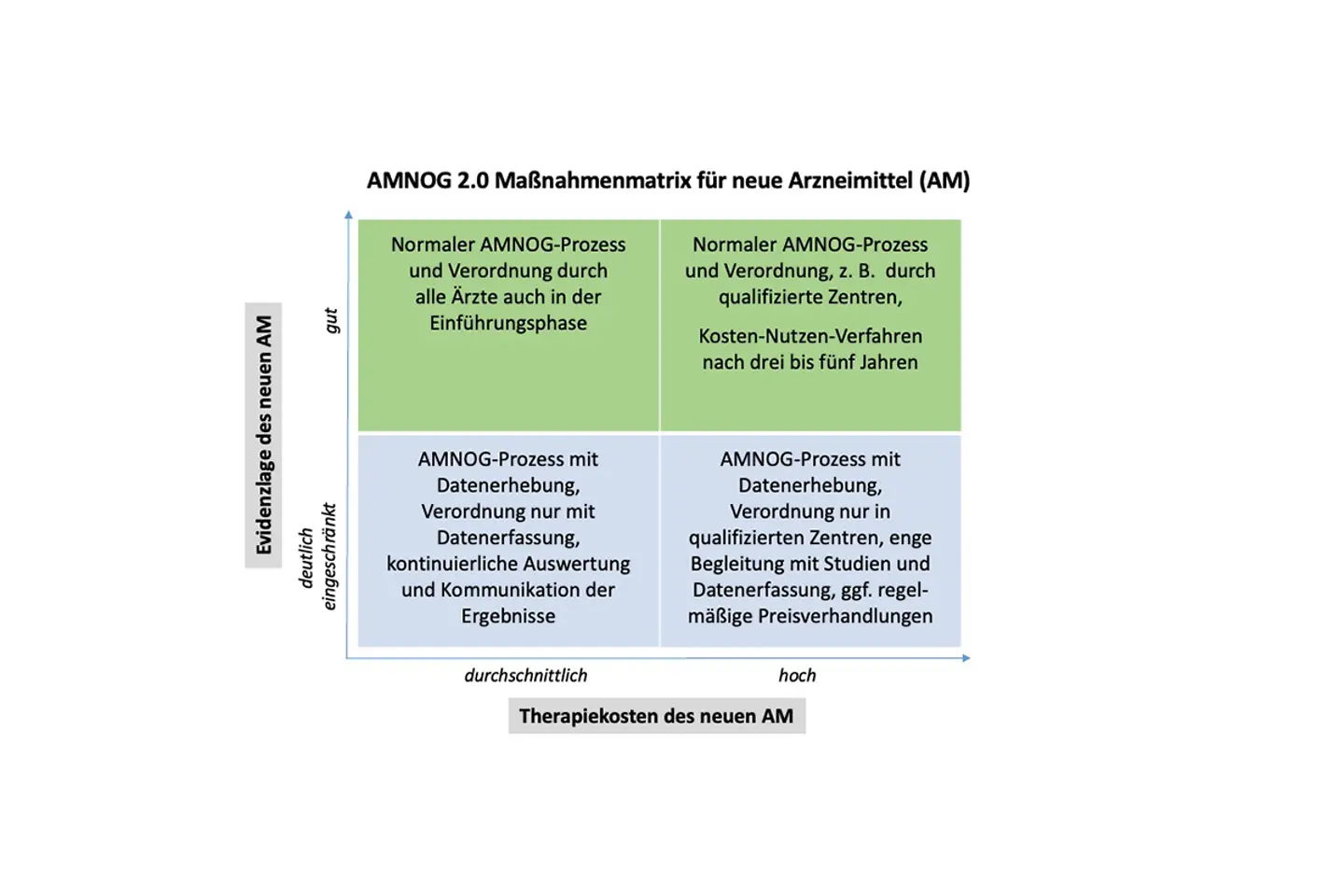
Das AMNOG-Verfahren sollte aus unserer Sicht an diese neuen Entwicklungen angepasst und flexibilisiert werden. Künftig sollten die Evidenz und der Preis, also die Therapiekosten, eines neuen Arzneimittels Kriterien dafür sein, wie dessen Einführung in Deutschland begleitet beziehungsweise gesteuert wird.
Bei Arzneimittelmitteln mit deutlich eingeschränkter Evidenz müssen zügig weitere Daten zu Risiken und Nutzen gewonnen werden. Dabei sollen auch die Routinedaten der Kassen berücksichtigt werden. Hierdurch können schneller Erkenntnisse zur Anwendung des Arzneimittels gewonnen werden, die wiederum den behandelnden Ärztinnen und Ärzten schneller zur Verfügung gestellt werden müssen.
Künftig sollten Evidenz und Preis Kriterien für das AMNOG-Verfahren sein.
Bei hochpreisigen Medikamenten sollte die Verordnung auf besonders qualifizierte Schwerpunktpraxen oder Krankenhäuser beschränkt werden. Dort muss der Einsatz des neuen Arzneimittels zudem mit einer real-world-Datenerfassung und -auswertung begleitet werden, um schnell die Evidenzlage der Therapie zu verbessern.
Bei Arzneimitteln mit guter Evidenzlage könnte das bisherige Verfahren beibehalten werden.
Was würde dies für das bisherige Verfahren bei Orphan Drugs bedeuten?
Eine Bevorzugung im Rahmen des AMNOG-Verfahrens durch die Unterstellung eines fiktiven Zusatznutzens sollte es künftig nur noch für jene Orphan Drugs geben, die als erste eine medikamentöse Therapie bei tatsächlich seltenen Erkrankungen ermöglichen und somit einen hohen medizinischen Bedarf adressieren. Alle anderen Orphan Drugs sollten sich einer regulären Zusatznutzenbewertung unterziehen müssen. Diese Verpflichtung würde zudem eine bessere vergleichende Datenlage für alle anderen Orphan Drugs gegenüber bereits verfügbaren Therapien fördern.